| 迈瑞CX | 您所在的位置:网站首页 › 精密度 cv › 迈瑞CX |
迈瑞CX
|
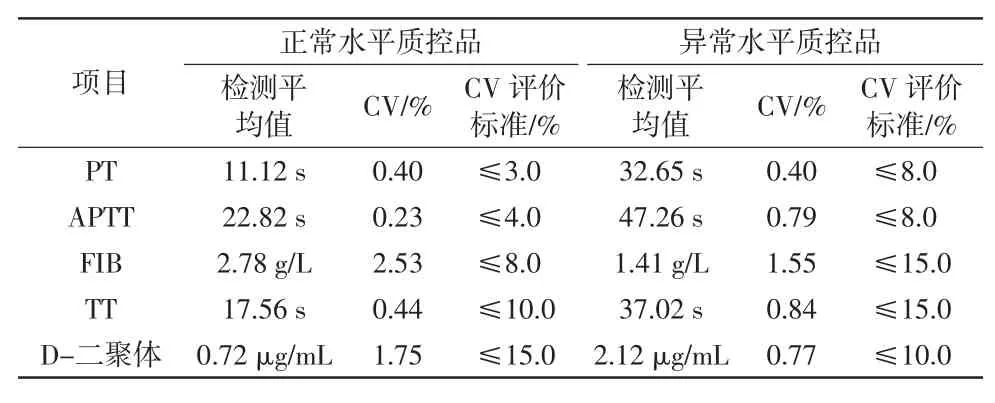
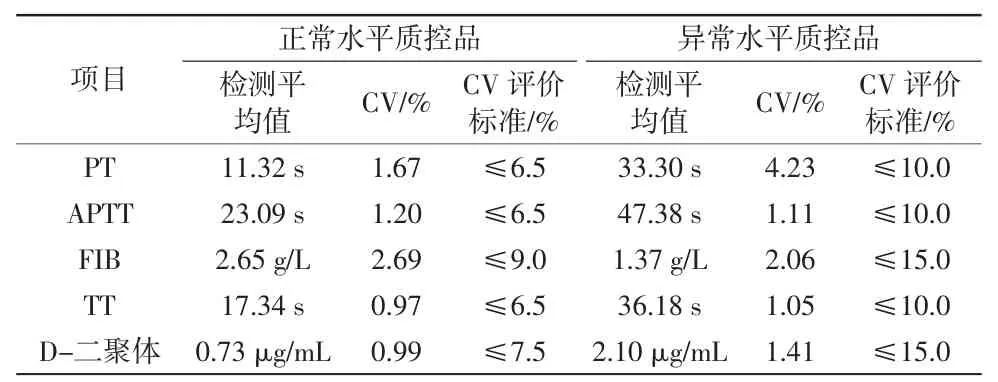
郭家权,韦 炅,李 苗,李坷坷,刘 明 (海南省人民医院检验科,海口 570311) 0 引言随着医学技术研究的逐渐深入,越来越多的疾病被证实与凝血系统有关。作为三大常规检查之一,凝血常规能够为出血与血栓性疾病的临床诊疗提供重要依据,其医学价值也日益凸显,与此同时临床对凝血检验的质量和效率等方面的要求也逐渐提高。为满足临床工作的需求,我院于2022 年6 月购置了一台CX-9000 全自动凝血分析仪。根据国家标准GB/T 22576.1—2018[1]对医学实验室质量和能力的要求,实验室应在医疗设备使用前验证其能够达到必要的性能并符合相关检验的标准。本研究对CX-9000全自动凝血分析仪检测凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、纤维蛋白原(fibrinogen,FIB)、凝血酶时间(thrombin time,TT)、D-二聚体5个凝血常规检查项目的性能进行验证,评估该仪器的精密度、准确度、线性范围、携带污染率、参考区间能否满足临床需求,旨在为临床检验凝血常规和相关医疗设备性能验证提供参考。 1 材料和方法1.1 材料1.1.1 仪器 采用深圳迈瑞生物医疗电子股份有限公司生产的CX-9000 全自动凝血分析仪。 1.1.2 试剂 采用CX-9000 全自动凝血分析仪厂家配套试剂,验证项目PT、APTT、FIB、TT、D-二聚体的试剂批号分别为0122030111、0222030111、0422030111、0322030111、0522030111。 1.1.3 质控品 使用厂家配套质控品,其中PT、APTT、FIB、TT的正常、异常质控品批号分别为8622030318、8722030 318,D-二聚体的正常、异常质控品批号分别为622 2030116、6322030116。 1.1.4 验证样本 本研究中的精密度及准确度验证样本分别为厂家配套的2 个水平质控品和企业参考物;线性范围、携带污染率及参考区间验证所采用的临床高、低浓度样本和健康人群样本均来源于海南省人民医院的门诊、住院患者及健康体检人群,样本采集自患者空腹静脉血,使用枸橼酸钠抗凝管(0.109 mol/L,枸橼酸钠与全血比例为1∶9)抗凝,采集后立刻颠倒混匀,并在1 500g 离心力下离心15 min,排除脂血、黄疸、溶血样本,所有试验均需在样本采集后4 h 内完成。 1.1.5 评价依据 参照国家卫生行业标准WS/T 477—2015[2]、WS/T 406—2012[3]、WS/T 402—2012[4]要求及国家医药行业标准YY/T 0659—2017[5]要求进行本研究评估验证。 1.2 方法本研究验证过程严格遵照检验操作规程,要求如下:(1)该仪器由具备资质的厂家工程师安装调试并完成校准;(2)完成FIB、D-二聚体的定标程序;(3)进行每日质控,于质控在控的情况下进行验证试验并收集数据。 1.2.1 精密度验证 1.2.1.1 批内精密度验证 参照YY/T 0659—2017 及WS/T 477—2015 行业标准进行批内精密度验证。取正常和异常2 个水平质控品,分别按常规方法重复检测10 次,计算检测结果的变异系数(coefficient of variation,CV),要求5 个项目2 个水平质控品的CV 分别符合以下标准:正常质控品PT≤3.0%、APTT≤4.0%、FIB≤8.0%、TT≤10.0%、D-二聚体≤15.0%;异常质控品PT≤8.0%、APTT≤8.0%、FIB≤15.0%、TT≤15.0%、D-二聚体≤10.0%。 1.2.1.2 日间精密度验证 参照WS/T 406—2012 及WS/T 477—2015 行业标准进行日间精密度验证。选择同一批号内正常和异常2 个水平质控品,在检测当天进行一次室内质控,剔除失控数据后(失控结果已得到纠正)按批号或者月份计算在控数据的CV,要求2 个水平质控品的CV 分别符合以下标准:正常质控品PT≤6.5%、APTT≤6.5%、FIB≤9.0%、TT≤6.5%、D-二聚体≤7.5%;异常质控品PT≤10.0%、APTT≤10.0%、FIB≤15.0%、TT≤10.0%、D-二聚体≤15.0%。 1.2.2 准确度验证 参照YY/T 0659—2017 行业标准进行准确度验证。使用厂家提供的2 个水平企业参考物,分别测定3 次,结果记为Xi,与预定靶值比较,分别计算相对偏差B,如3 次验证结果均符合评价标准,即判为合格。如果≥2 次的结果不符合评价标准,即判为不合格。如有1 次结果不符合评价标准,则应重新连续测定20 次,并重新计算相对偏差B,如≥19 次的验证结果符合标准,则准确度评价合格。相关评价标准要求FIB 的相对偏差应在±10%以内。 1.2.3 线性范围验证 参照YY/T 0659—2017 及WS/T 477—2015 行业标准进行线性范围验证。取1 份接近线性范围上限(H)和1 份接近线性范围下限(L)的样本血浆,配制6份稀释浓度的样本(5L、4L+H、3L+2H、2L+3H、L+4H、5H)。每个稀释浓度重复测定3 次,计算均值,用实测值(Y)与理论值(X)进行线性回归分析,根据回归方程得出相关系数(r)和斜率(k),评价要求k 在1.00±0.05 范围内,r≥0.975。 1.2.4 携带污染率验证 参照YY/T 0659—2017 行业标准进行携带污染率验证,包含样品浓度携带污染率(CR1)验证和项目携带污染率(CR2)验证,具体步骤如下:(1)CR1验证:取1 份高浓度的临床样本(H),混合均匀后连续测定3 次(H1、H2、H3),再取1 份低浓度的临床样本(L),混合均匀后连续测定3 次,按公式CR1=|(L1-L3)|/(H3-L3)×100%计算CR1。(2)CR2验证:连续测定临床样本的PT 或APTT 3 次(j1、j2、j3)后,立即连续测定FIB 或TT 3 次,再测定PT 或APTT 1 次(j4),按公式CR2=[(j1+j2+j3)/3-j4]/[(j1+j2+j3)/3]×100%计算CR2。评价要求CR1及CR2均应≤10%。 1.2.5 参考区间验证 参照WS/T 402—2012 行业标准进行参考区间验证。选取20 份健康人群样本(男性女性各15 份,年龄为20~60 岁,无服药史、无出血史及其他影响本试验的疾病),分别测定PT、APTT、FIB、TT、D-二聚体5 个项目,验证厂家提供的参考区间,按公式R=检测值在应用参考区间的参考个体数/总的参考个体数计算R 值,评价要求R≥90%。 1.3 统计学分析所有检测数据均通过Microsoft Excel 2019 版软件进行统计分析。 2 结果2.1 批内精密度验证结果CX-9000 全自动凝血分析仪检测PT、APTT、FIB、TT、D-二聚体5 个凝血常规检查项目的批内精密度CV 均<3%(详见表1),表明该仪器的批内精密度符合行业标准要求,验证合格。
表1 批内精密度验证结果 2.2 日间精密度验证结果CX-9000 全自动凝血分析仪检测PT、APTT、FIB、TT、D-二聚体5 个项目的日间精密度CV 均<5%(详见表2),表明该仪器的日间精密度符合行业标准要求,验证合格。
表2 日间精密度验证结果 2.3 准确度验证结果CX-9000 全自动凝血分析仪检测2 个水平企业参考物的准确度结果(详见表3),将3 次结果与厂家提供的预定靶值比较,相对偏差B 均在±10%以内,表明该仪器的准确度符合行业标准要求,验证合格。
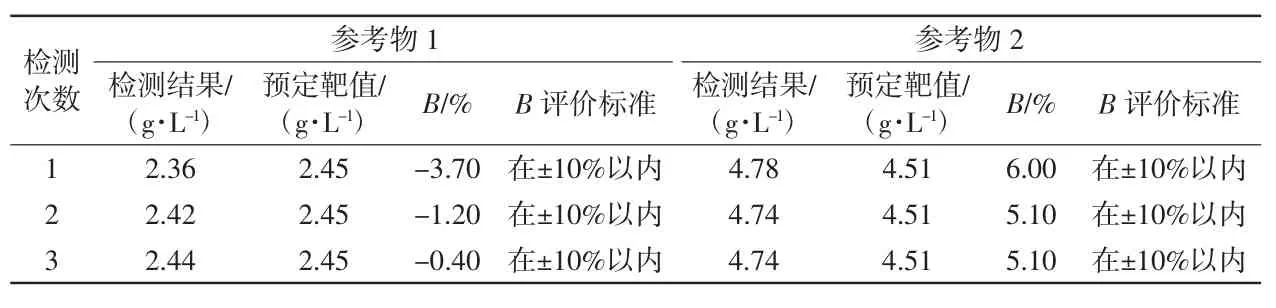
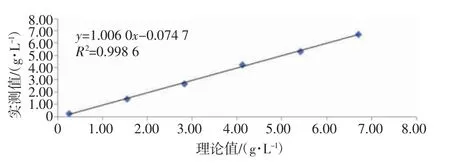
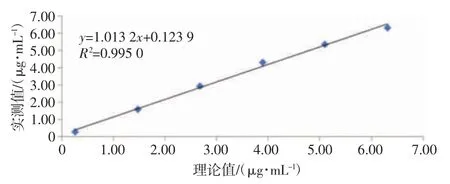
表3 准确度验证结果 2.4 线性范围验证结果CX-9000 全自动凝血分析仪的FIB 及D-二聚体线性范围验证结果详见表4。FIB 的线性回归方程为y=1.006 0x-0.074 7,k 为1.006 0,r 为0.999 3(如图1 所示);D-二聚体的线性回归方程为y=1.013 2x+0.123 9,k 为1.013 2,r 为0.997 5(如图2 所示),表明该仪器线性良好,符合行业标准要求,验证合格。
图1 FIB 线性回归散点图
图2 D-二聚体线性回归图
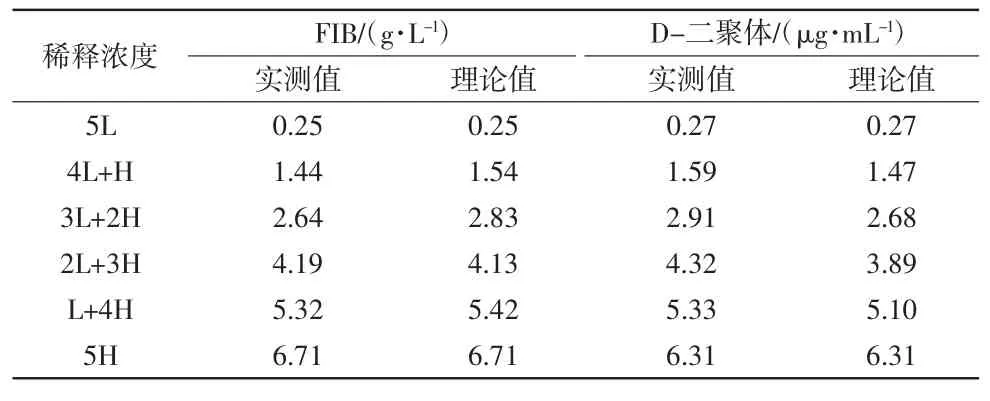
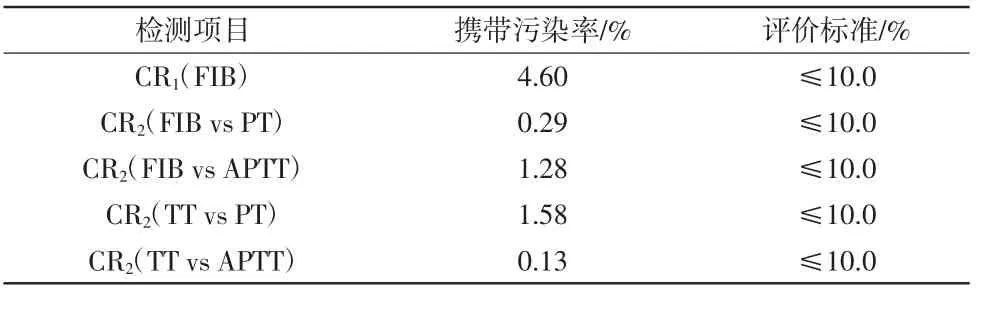
表4 线性范围验证结果 2.5 携带污染率验证结果CX-9000 全自动凝血分析仪的携带污染率验证结果详见表5。CR1为4.60%,CR2均<2%,结果表明该仪器符合行业标准要求,验证合格。
表5 携带污染率验证结果 2.6 参考区间验证结果CX-9000 全自动凝血分析仪的参考区间验证结果详见表6。可见所有样本于5 个检测项目的R 值均为100%,表明该仪器所提供的参考区间适用于本实验室,验证合格。 3 讨论CX-9000 全自动凝血分析仪是深圳迈瑞生物医疗电子股份有限公司生产的新一代凝血检测设备,其具备高恒速(450 个/h 测试)、超长试剂在机稳定期(2周)以及7 步全自动化(APTT 纠正实验)等诸多优点,能够提升实验室对样本的检验转化时间管理效率,同时该仪器配备了全液体联杯试剂盒,可有效减少传统凝血分析仪干粉试剂复溶操作可能带来的结果误差问题,其不停机加载耗材和空试剂盒自动丢弃的功能在凝血设备行业内为突破性的变革。 检测系统是完成一个检测项目所需的仪器、试剂、校准品、操作程序、操作人员等的组合[6]。虽然仪器制造商已经为实验室新增的检测系统提供了仪器性能的初步参数,但由于地区和实验室的差异,各实验室应在仪器正式投入使用并用于报告患者检测结果之前重新进行性能评估,以确保仪器的分析性能能够满足检测和临床要求,保证结果准确可靠[7]。本实验室依照国家卫生健康委员会及原国家食品药品监督管理局颁布的相关卫生及医药行业标准对该仪器进行了较为全面的性能评估。 精密度是评价医学实验室仪器性能的一个重要指标,是在规定条件下对同一或相似被测对象重复测量得到的测量示值或测得量值间的一致程度[5],是其他性能指标的基础[8]。本研究以批内精密度和日间精密度来评估CX-9000 全自动凝血分析仪,5 个项目批内精密度的CV 均<3%,日间精密度的CV均<5%,表明该仪器具有良好的稳定性和重复性。 准确度是一个测得量值与被测量的一个真量值间的一致程度[5],本研究采用厂家配套的2 个水平企业参考物进行准确度验证[9],结果显示FIB 项目2 个水平企业参考物的相对偏差均在±10%以内,表明该仪器符合行业标准要求,可为患者提供准确可靠的检测结果。 在线性范围的验证中,由于CX-9000 全自动凝血分析仪对PT、APTT 和TT 项目检测采用的是凝固法,使用时间单位报告结果,故不宜进行线性分析[10],本研究根据行业标准要求仅对FIB 和D-二聚体2 个项目进行评估。从线性回归方程数据显示,2 个项目的线性斜率k 和相关系数r 均符合标准要求,说明该仪器线性良好且范围宽,可有效降低样本重测率。 携带污染率的具体量化指标反映了一个样本对下一个样本表现量的影响大小[5],如携带污染率未达到行业标准要求,将会给实验室异常结果排查带来困难。通过验证,可见CX-9000 全自动凝血分析仪的浓度及项目携带污染率均符合行业标准要求,说明该仪器样本或试剂间的交叉污染率低。 各检查项目的参考区间可能因人群而异,故在使用厂家声明的参考区间之前需要验证其是否适合本实验室[11]。本实验采用“小样本验证[4]”方法进行参考区间验证,结果显示5 个项目检测值在应用参考区间的参考个体数占总个体数的比例均达到100%,说明本实验室可使用厂家提供的参考区间。 根据中国合格评定国家认可委员会颁布的CNAS-CL02-A001:2018《医学实验室质量和能力认可准则在临床血液学检验领域的应用说明》文件对仪器结果比对的要求,考虑CX-9000 全自动凝血分析仪为上市后全国首台装机设备,同时与本实验室在用凝血分析仪所开展项目的生物参考区间存在差异,因此未进行实验室内、外部结果比对验证,仅对医疗安全风险进行评估,上述为本研究验证的不足之处,在日后工作中仍需进一步完善。 综上所述,CX-9000 全自动凝血分析仪的主要分析性能符合临床检测需求,同时也符合标准化实验室质量管理的要求,是一款精密度好、准确度高、线性范围宽、携带污染率低的检测仪器。 |
【本文地址】